Modelo atómico de Lewis (1902 d.C)

También llamado “Diagrama de punto y raya diagonal”, “Diagrama de valencia”, “Diagrama de Lewis”, “Modelo del Átomo Cúbico” o “Regla de octeto”.
Gilbert N. Lewis propuso una representación gráfica de la estructura de los átomos o molécula no polar distribuida en forma de cubo, en cuyos ocho vértices se hallaban los electrones.
Fue publicada su teoría, en 1916, con el objetivo de explicar el fenómeno de la valencia atómica y, a pesar de que rápidamente se abandonó en favor del modelo de mecánica cuántica basado en la ecuación de Schrödinger, tiene una importancia histórica gracias a su aporte en el entendimiento de los enlaces químicos.
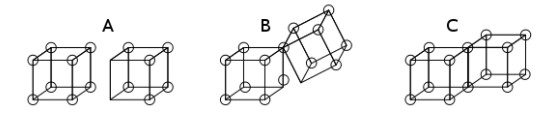
- Los enlaces covalentes simples se forman cuando dos átomos comparten un borde (Estructura C) y esto resulta en el intercambio de dos electrones.
- Los enlaces iónicos se forman por la transferencia de un electrón de un cubo a otro sin compartir un borde (estructura A).
- Un estado intermedio en el que sólo se comparte un rincón (estructura B) también fue postulado por Lewis.
- Los enlaces dobles se forman al compartir una cara entre dos átomos cúbicos. Esto resulta en compartir cuatro electrones.

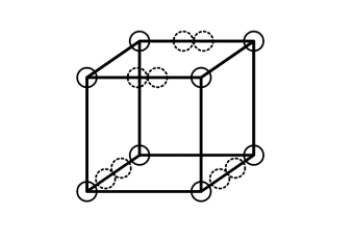
El modelo de átomo cúbico no pudo explicar los enlaces triples, porque no hay forma de que dos cubos compartan tres bordes paralelos. Lewis sugirió que los pares de electrones en los enlaces atómicos tienen una atracción especial, que dan lugar a una estructura tetraédrica, en donde la nueva ubicación de los electrones está representada por los círculos punteados en el centro de los bordes gruesos. Esto permite la formación de un vínculo simple al compartir una esquina, un vínculo doble al compartir un borde, y un vínculo triple al compartir una cara. También explica la libre rotación alrededor de los enlaces simples y la geometría tetraédrica del metano.
Este modelo sufrió una actualización por parte de Irving Langmuir, en 1919, donde planteó el “átomo del octeto cúbico”.

